Дослідження структурних змін у субфасціальній ділянці скелетних м’язів гомілки після травматичної ішемії та впливу регенеративних технологій на відновлювальні процеси (експериментальне дослідження)
А. Т. Підлісецький 1, 2, О. В. Долгополов 1, С. І. Савосько 3, О. М. Макаренко 4
1 ДУ «Інститут травматології та ортопедії НАМН України», Київ
2 КНП ЛОР «Львівський обласний госпіталь ветеранів війн та репресованих імені Ю. Липи». Україна
3 Національний медичний університет ім. О. О. Богомольця, кафедра гістології та ембріології, Київ. Україна
4 Міжрегіональна Академія управління персоналом, Київ. Україна
Тактика ведення та лікування пацієнтів із післятравматичною ішемією м’язів кінцівок є визначальною на всіх етапах, тому розроблюють новітні методи лікування зі застосуванням клітинних технологій для попередження розвитку ускладнень і покращення віддалених результатів.
Мета. Визначити в експерименті гістологічні зміни в м’язах ушкодженої кінцівки після травматичної ішемії за умов введення збагаченої тромбоцитами плазми, аспірата кісткового мозку та стромальноваскулярної фракції жирової тканини. Методи. Роботу виконано на 65 кролях породи Шиншила вагою 4,2– 4,5 кг. Тваринам накладали джгут на ліву нижню кінцівку від середньої третини стегна до надп’ятковогомілкового суглоба, який через 6 год знімали. Після цього тварин розділили на 4 групи: 1ша — ішеміяконтроль, 2га — введення збагаченої тромбоцитами плазми, 3тя — введення клітин аспірата кісткового мозку, 4та — стромальноваскулярної фракції жирової тканини. На 5, 15, 30ту доби по 5 тварин із кожної групи виводили з експерименту та виконували гістологічні дослідження.
Результати. На 5ту добу після моделювання в усіх групах кролів виявлено набряк м’язової тканини, дегенерацію та фрагментацію м’язових волокон у субфасціальній ділянці. На 15 і 30ту доби в 3й і 4й групах зафіксовано формування нових м’язових волокон на місцях некрозу, появу міотубул із міоядер. На 30 ту добу в групі контрольішемія домінувала атрофія м’язових волокон.
Висновки. Травматична ішемія кінцівки кролів протягом 6 год спричинює дегенерацію та прогресування гіпотрофії м’язових волокон скелетних м’язів гомілки. Введення збагаченої тромбоцитами плазми, аспірата кісткового мозку та стромальноваскулярної фракції жирової тканини не призводить до відновлення м’язової тканини в субфасціальних ділянках, але позначається на частковому збереженні м’язових волокон глибоких міонів м’яза.
Ключові слова. Кролі, травматична ішемія, нижня кінцівка, некроз, гістологічні зміни в м’язах
Вступ
Атрофія скелетних м’язів на фоні тяжкої травми нервів кінцівки і травматичної ішемії є стійкою, а функція кінцівки — значно погіршеною. Навіть за умов раннього й успішного мікрохірургічного відновлення периферичних нервів, кровоносних судин кінцівки й адекватної післяопераційної терапії неможливо з високою ймовірністю прогнозувати ступінь відновлення м’язів кінцівки, атрофія яких може бути незворотною, із розвитком фіброзу, контрактур та інвазії жировою тканиною. За умов виникнення атрофії м’язових волокон після різних ушкоджень є тенденція до наростання різного ступеня незворотних морфологічних змін, навіть після лікування дефіцит функції кінцівки є неминучим [1, 2].
Відомо, що скелетні м’язи мають потенціал до регенерації у відповідь на різні типи ушкоджень, такі як травма, ішемія та деякі типи м’язової дистрофії [2–5]. Проте структурні основи та динаміка відновлення в скелетних м’язах досліджені недостатньо. Передбачають, що регенерацію м’язової тканини можна стимулювати шляхом використання аутологічних клітинних технологій. Зокрема встановлено, що введення пацієнтам із критичною ішемією кінцівки мезенхімальних стромальних клітин (МСК), одержаних із кісткового мозку, стимулювало ангіогенез і дало змогу зберегти ішемічно уражену кінцівку в близько 80 % випадків [6]. Дослідження впливу МСК кісткового мозку показали їхню стимулювальну дію на проліферацію та міграцію ендотеліальних клітин і диференціацію міобластів [7]. Проте слід ураховувати, що близько 98 % клітин в аспіраті кісткового мозку є популяцією гемопоетичних клітин, а решта 2 % — попередники ендотеліоцитів і деякі інші клітини [8, 9].
Як альтернативу ізольованим МСК пропонують використовувати в травматології для стимуляції регенерації тканин після травматичних ушкоджень концентрований аутологічний аспірат кісткового мозку, одержані з жирової тканини клітини та концентрат тромбоцитарної плазми [10].
Раніше ми виявили ушкодження периферійного нерва кінцівки, структурні та біохімічні зміни скелетних м’язів після травматичної ішемії, суттєву атрофію м’язових волокон із фібротизацією, а також клітинну реорганізацію вздовж окремих м’язових волокон, що може бути раннім проявом регенерації [11]. Морфометрія ушкоджених м’язових волокон не дозволила цілком оцінити відновні процеси без і після введення суспензій аутологічних клітин, хоча це зручний спосіб лінійного вимірювання м’язових волокон, динаміки їхньої атрофії. Аналіз біохімічних змін у м’язах указує на порушення окисно-відновних процесів і стрімке нагромадження продуктів перекисного окиснення ліпідів, які можуть здійснювати цитотоксичну дію на ушкоджені клітини і, відповідно, провокувати перманентні порушення [12].
У цьому дослідженні ми додатково використали трансмісійну електронну мікроскопію для аналізу реакцій клітин-сателітів в ушкоджених ділянках м’язів. Ґрунтуючись на опублікованих працях, раніше не порівнювали ці зміни після травматичної ішемії та введення тромбоцитарної плазми й аспіратів клітин. Усе зазначене свідчить про актуальність проблеми вивчення морфологічних основ регенерації скелетних м’язів після травматичної ішемії та виявлення явищ актива-ії відновних процесів або небажаних наслідків застосування тканинних технологій у травматології.
Мета дослідження: дослідити регенерацію м’язів гомілки після травматичної ішемії та введення тромбоцитарної плазми, аспірата клітин кісткового мозку та жирової тканини.
Матеріали та методи
Експерименти проведено на 65 кролях породи Шиншила вагою 4,2–4,5 кг. Тваринам моделювали механічну ішемію лівої задньої кінцівки.
Для цього на неї накладами медичний еластичний джгут (ширина 5,5 см) від середньої третини стегна до надп’ятково-гомілкового суглоба, тим самим іммобілізували кінцівку та спричинювали порушення перфузії судин. Через 6 год джгут знімали та розподілили тварин на 4 групи по 15 особин у кожній: 1-ша — ішемія-контроль, 2-га — введення тромбоцитарного концентрату плазми, 3-тя — аспірата клітин кісткового мозку, 4-та — стромально-васкулярної фракції жирової тканини. По 5 кролів із кожної групи виводили з експерименту на 5, 15 і 30-ту доби.
Для морфометричного дослідження додатково використано 5 інтактних кролів. Тварин наркотизували тіопенталом натрію у дозі 60 мг/кг (внутрішньоочеревинно).
Усі маніпуляції з тваринами виконано відповідно до положень Європейської конвенції про захист хребетних тварин, що використовуються для експериментальних та інших наукових цілей, № 123, Рада Європи, L222, 24.08.1999 і комісії з біоетики ДУ «Інститут травматології та ортопедії при НАМН України» (протокол № 4 від 10.12.2021).
Приготування концентрату тромбоцитарної плазми
Здійснювали забір крові з вушної вени кроля у кількості 5 мл, яку поміщали в спеціальну пробірку для отримання концентрату тромбоцитарної маси. Після чого проводили центрифугування за 760 g протягом 8 хв. Отриманий концентрат евакуювали у 5 мл шприц і вводили в задній глибокий футляр гомілки.
Одержання аспірата клітин кісткового мозку
Аутологічний аспірат клітин кісткового мозку отримували з проксимального відділу стегна кролів. Кістковий троакар (діаметр 10 G) вводили в проксимальний відділ стегна, шприцом 5 мл виконували аспірацію кісткового мозку в об’ємі 2 мл. Аспірат сепарували через фільтр Tulip Emulsifier™, додавали антикоагулянт цитрат декстрози АЦД-А. Отриманий аспірат центрифугували за 760 g протягом 8 хв та проводили аспірацію 1 мл верхнього шару плазми та клітинного шару (55 800 клітин/мл).
Одержання стромальноваскулярної фракції жирової тканини
Через доступ до 2 см виконували забір 5 мг черевного сальника, який подрібнювали механічним способом до стану суспензії, котру гомогенізували за допомогою пропускання систем у двох з’єднаних шприців через 1 мм отвір. Після чого її центрифугували за 760 g протягом 8 хв.Концентрат тромбоцитарної плазми, клітини аспірата кісткового мозку та суспензії жирової тканини вводили в середню третину литкового м’яза.
Гістологічні дослідження
Фрагменти м’язів тварин із ділянкою введення клітин і плазми фіксували в 10 % розчині формаліну на фосфатному буфері (рН = 7,4) упродовж 24 год за температури 4 oC. Потім зразки промивали, зневоднювали в розчині ізопропанолу з хлороформом (70–99,8 %) (1:1) та заливали в парафін.
На мікротомі Thermo Microm HM 360 (Thermo Fisher Scientific, США) виготовляли зрізи товщиною 6 мкм, депарафінували, забарвлювали гематоксиліном та еозином. Морфометрію м’язових волокон (діаметр, мкм) здійснювали за допомогою програмного забезпечення Carl Zeiss (AxioVision SE64 Rel.4.9.1) (Carl Zeiss Microscopy, LLC, США) та мікроскопа BX 51 (Olympus, Японія).
Трансмісійна електронна мікроскопія (ТЕМ)
Зразки м’язів фіксували у 2,5 % розчині глутаральдегіду у фосфатному буфері з наступною дофіксацією 1 % OsO4, зневоднювали в етанолі й ацетоні, ущільнювали в епоксидній смолі (Epon 812, Araldite 502). Ультратонкі зрізи з епоксидних блоків одержували на ультратомі Reichert-Jung (Ultracut E, Німеччина). Зрізи фіксували на вольфрамових сітках і контрастували 2 % розчином уранілацетату та цитратом свинцю.
Зразки досліджували на скануючому електронному мікроскопі Tescan Mira 3 LMU (Чехія) у режимі трансмісійної мікроскопії (STEM).
Статистичні дослідження проведено в програмі Origin Lab 8.0. Показники подані у вигляді M ± m, де М — середнє значення, m — стандартна похибка. Групи порівнювали за допомогою непараметричного критерію Крускала-Уоліса. Різниці вважали суттєвими з р < 0,05.
Результати та їх обговорення
За результатами гістологічних досліджень субфасціальної ділянки м’язів у контрольній групі тварин з ішемією, у групах після введення концентрату тромбоцитарної плазми, клітин аспірата кісткового мозку та стромально-васкулярної фракції жирової тканини на 5, 15 і 30-ту доби виявлено структурні порушення у м’язових волокнах, сполучній тканині ендомізію та перимізію.
У групі ішемія-контроль (рис. 1, а, б, в) зафіксовано набряк, суттєве зменшення товщини або фрагментацію м’язових волокон, їхню атрофію на 30-ту добу. На 5-ту добу внаслідок набряку між м’язовими волокнами збільшився інтерстиційний простір. Одночасно виявлено волокна з ознаками атрофії та з додатковими ядрами (рис. 1, а). В ендомізії та перимізії зафіксовано розшарування колагенових волокон унаслідок набряку, ділянки з мононуклеарною інфільтрацією, стаз судин капілярного типу. За допомогою ТЕМ виявлено ділянки клітинного детриту та макрофагів із фагосомами, зафіксовано активний фагоцитоз та утилізацію цих продуктів (рис. 2, а).
Після введення тромбоцитарної плазми на 5-ту добу, як і у групі ішемія-контроль, визначено зміни щільності та форми м’язових волокон, їхнє роз’єднання внаслідок набряку ендомізію. У деяких м’язових волокнах зафіксовано збільшення кількості ядер по контуру волокна, що можна розглядати як прояв регенерації (рис. 1, г). За допомогою ТЕМ встановлено деструктивні зміни фібробластів перимізію — лізис ядер, вакуолізацію цитоплазми. Визначено появу макрофагів (рис. 2, г). Відомо, що регенерація скелетних м’язів передбачає симбіоз макрофагів і міобластів [3].
Введення аспірата клітин кісткового мозку не сприяло поліпшенню структури дегенеративно змінених м’язових волокон унаслідок ішемії
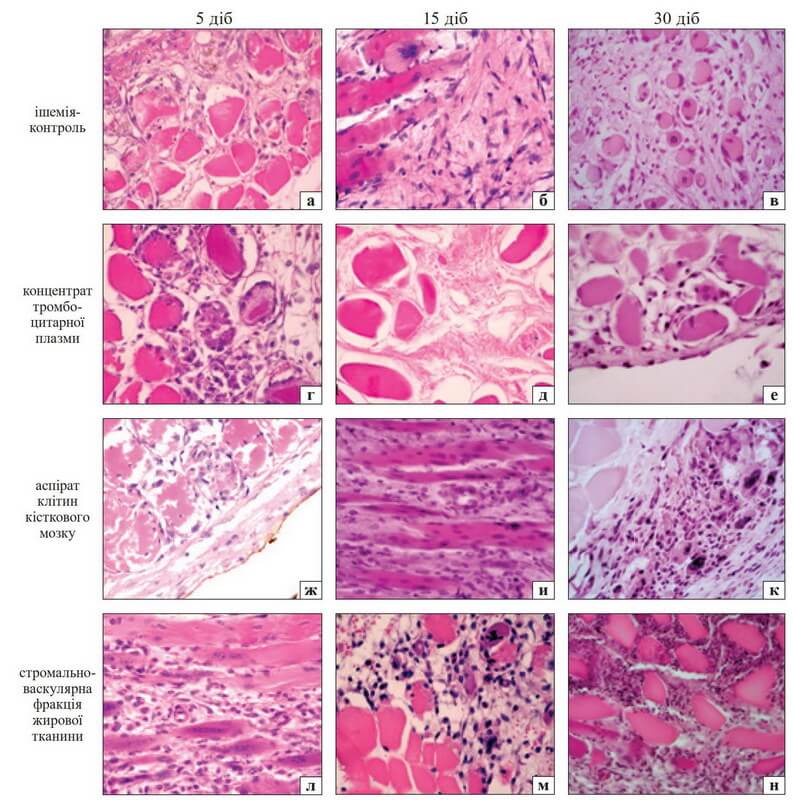
Рис. 1. Структурні зміни у субфасціальній ділянці скелетних м’язів гомілки кролів з ішемією кінцівки (а–в) та введенням тромбоцитарного концентрату плазми (г–е), аспірата клітин кісткового мозку (ж–к), стромально-васкулярної фракції кісткової тканини (л–о). Дегенерація м’язових волокон у всіх групах на 5-ту добу та на всі терміни в 4-й групі (л–н); запальна інфільтрація (н); поява груп ядер в ушкоджених волокнах (в, д, е, и, к). Гематоксилін та еозин. Об. 40, ок. 10
Відмічено глибчастий розпад м’язових волокон (рис. 1, ж), проліферацію фібробластів між м’язовими волокнами, порушення гістоархітектоніки ендомізію (рис. 2, ж).
Після введення в ділянку м’яза стромально-васкулярної фракції жирової тканини також спостерігали деструктивні порушення м’язових волокон, проте поміж ними вже на 5-ту добу розташовувалися мононуклеарні клітини та фібробласти (рис. 1, л). У м’язових волокнах виявлено по здовжньо орієнтовані стрічки ядер, що є проявом регенерації. У ділянках деструкції переважали макрофаги з фагосомами, зафіксовано елімінацію з інтерстиційного простору клітинного детриту та ліпідні гранули, що походять від адипоцитів (рис. 2, г).
Через 15 діб після моделювання ішемії в усіх серіях експерименту відмічено схожі дегенеративні зміни, а саме: витончення м’язових волокон із порушенням поперекової посмугованості на поздовжніх зрізах, центральне розташування ядер, ознаки атрофії. Зберігався набряк, що призвело до роз’єднання м’язових волокон (рис. 1, д, м). Після введення тромбоцитарного концентрату плазми було виявлено групи м’язових волокон без ядер, що також вказує на їхню атрофію (рис. 1, д). Відбулось ремоделювання ендомізію й перимізію з утворенням пухкої сполучної тканини (рис. 1, б, и).
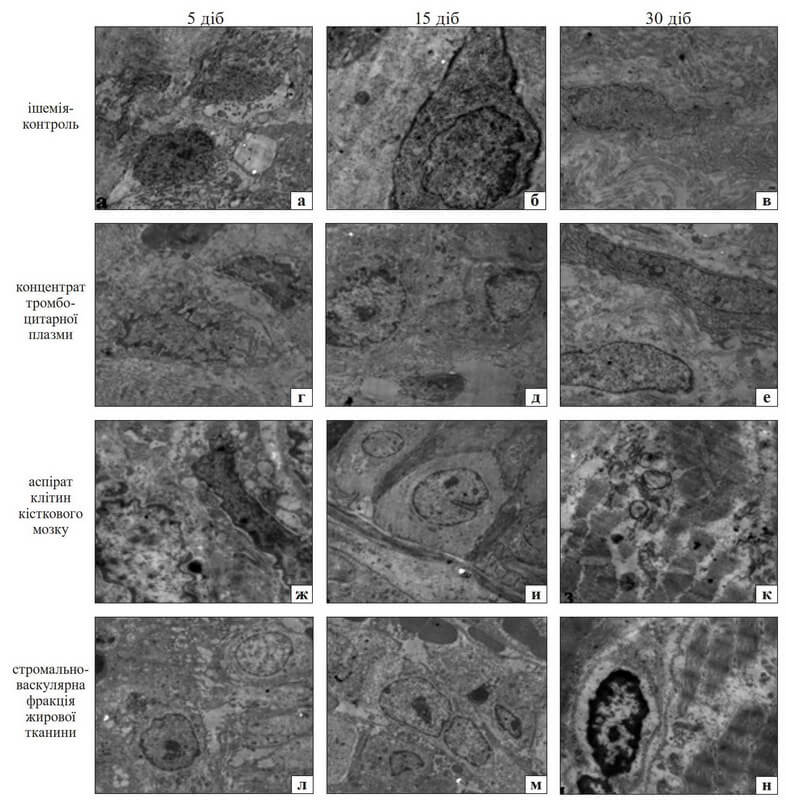
Рис. 2. Ділянки ушкодження м’язів гомілки з ішемією кінцівки (а–в) та подальшим введенням тромбоцитарного концентрату плазми (г–е), аспірата клітин кісткового мозку (ж–к), стромально-васкулярної фракції жирової тканини (л–н). Макрофаги на 5-ту добу в усіх групах; клітини-сателіти на 15-ту добу (и, м); збільшення щільності колагену (ж); ламелярні атипові тільця у м’язових волокнах (к). Контрастування оксидом осмію й уранілацетатом ТЕМ. Збільшення 60 000 (ж, к, н); 30 000 (г, д, е); 22 000 (а–в, и)
За електронномікроскопічним дослідженням у групі контроль-ішемія та після введення концентрату тромбоцитарної плазми реєстрували ділянки з фібробластами, колагеногенезом (рис. 2 б, д). Після введення аспірата клітин кісткового мозку та клітин жирової тканини зафіксовано ділянки зі стрічками з клітин-сателітів, подекуди відмічено формування міотубул (рис. 2, и, м), що є ознакою регенерації.
Міобласти мали великі ядра, в них домінував еухроматин, а у цитоплазмі не реєстрували міофібрил. За науковою інформацією, міобластична диференціація починається з активації резидентних клітин-сателітів [13].
На 30-ту добу в м’язах переважали дегенеративні зміни в усіх серіях експерименту. На різних ділянках перимізію й ендомізію спостерігали фіброз. Істотну атрофію м’язових волокон зафіксовано в групі ішемія-контроль (рис. 1, в), а після введення клітин жирової тканини відмічено додаткові запальні інфільтрати (рис. 1, н). Регенеративні зміни були пов’язані з проліферацією клітин, наявністю сателітів і макрофагів. У глибоких міонах виявлено появу додаткових ядер уздовж м’язових волокон, що також є проявом регенерації. У процесі електронно-мікроскопічного дослідження на цей термін спостереження визначено збільшення кількості фібробластів і колагену (рис. 2, в, е), у м’язових волокнах — атипові ламелярні структури, що є проявом аутофагії (рис. 2, к). У структурно збережених м’язових волокнах зафіксовано міофібрили з межами саркомерів, хоча щільність фібрил в актин-міозинових комплексах була зменшеною (рис. 2, н).
За результатами морфометричного дослідження м’язові волокна глибокої зони на 30-ту добу після ішемії кінцівки мали значно менший діаметр порівняно з показником інтактної групи — (41,9 ± 2,5) мкм проти (81,5 ± 1,4) мкм (р < 0,05).
Після введення тромбоцитарної плазми ширина м’язових волокон виявилася більшою порівняно з 1-ю групою експерименту в 1,7 разу, проте не досягала контрольних показників — (70,5 ± 1,8) мкм проти (81,5 ± 1,4) мкм (р < 0,05). Зростання ширини м’язових волокон зафіксовано також у серії з введенням клітин кісткового мозку — (65,2 ± 2,2) мкм, зі стромально-васкулярною фракцією жирової тканини — (45,7 ± 1,7) мкм.
Ці величини також виявилися суттєво меншими (р < 0,05) порівняно з інтактною групою.Відомо, що для значних ушкоджень скелетної м’язової тканини характерною є низька репаративна спроможність, що обумовлює проведення досліджень щодо використання різних технологій стимуляції регенерації [14]. Проте особливості використання клітинних технологій і збагаченої тромбоцитами плазми потребують поглибленого виявлення, бо дотепер за їхнім застосуванням повідомлено лише про часткове відновлення м’язової тканини [15]. Поліпшення запального стану, зменшення розміру фіброзного рубця та відновлення продемонстровано в оброблених PRP уражених м’язах [16]. У разі використання концентрату тромбоцитарної плазми на всі терміни експерименту ми спостерігали дегенеративні зміни м’язової тканини з формуванням ділянок фіброзу. Після введення аспірата клітин кісткового мозку та стромально-васкулярної фракції жирової тканини відмічено підвищення репаративних проявів, хоча в 4-й групі розвинулася запальна інфільтрація, що є небажаним наслідком застосування клітин, одержаних із жирової тканини.
Таким чином, проведені гістологічні й електронно-мікроскопічні дослідження дозволили зробити кілька важливих висновків. По-перше, у наслідок 6-годинної механічної ішемії розвиваються дегенеративні зміни в скелетних м’язах кінцівки з вираженими проявами в ділянках субфасціальних міонів, а м’язи глибоких міонів зазнають гіпотрофії, що проявляється значним зменшенням товщини м’язових волокон. По-друге, застосування тканинних технологій лише частково запобігає прогресуванню деструктивних змін м’язів у віддалений термін. Ішемічне ушкодження поверхневих міонів у субфасціальній ділянці є необоротним. Введення клітин аспірата кісткового мозку, стромально-васкулярної фракції жирової тканини та концентрату тромбоцитарної плазми не призвело до регенерації м’язів. На кінцевий термін спостереження (30-та доба) зберігаються деструктивні зміни м’язових волокон, набряк, фібротизація ендомізію та перимізію. Проте на межі некрозу відбувається регенерація окремих м’язових волокон, що за даними електронної мікроскопії виявлено починаючи з 15-ї доби. Дискусійним є питання частоти введення досліджених чинників і ймовірно кілька ін’єкцій сприяло б покращенню результатів, що потребує подальшого дослідження. Відомо, що наслідки травматичної ішемії в м’язах залежать від стану кровоносної мікроциркуляції, проте в поданій роботі ці дані не висвітлено.
Висновки
Травматична ішемія кінцівки кролів протягом 6 год спричинює розвиток дегенеративних змін із прогресуюванням гіпотрофії м’язових волокон скелетних м’язів гомілки. Введення тромбоцитарної плазми, аспірата кісткового мозку та стромально-васкулярної фракції жирової тканини не приводить до відновлення м’язової тканини в субфасціальних ділянках, проте позначається на частковому збереженні м’язових волокон глибоких міонів м’язу, що виявлено за морфометричними дослідженнями на 30-ту добу експерименту.
Конфлікт інтересів. Автори декларують відсутність конфлікту інтересів.
Список використаних джерел / References
1. Savel’ev V. A. Long-term results of restoration of the peripheral nerve trunks of the upper extremities: a clinical and experimental study : / abstract dis. … candidate of medical sciences / V. А. Savel’ev . — Dushanbe, 2009. — 23 p.
2. Satellite cells CD44 positive drive muscle regeneration in osteoarthritis patients / M. Scimeca, E. Bonanno, E. Piccirilli [et al.] // Stem Cells International. — 2015. — Vol. 2015. — Article ID: 469459. — DOI: 10.1155/2015/469459.
3. Skeletal muscle regeneration involves macrophage-myoblast bonding / L. C. Ceafalan, T. E. Fertig, A. C. Popescu [et al.] // Cell Adhesion & Migration. — 2018. — Vol. 12 (3). — P. 228– 235. — DOI: 10.1080/19336918.2017.1346774.
4. Pax7 is required for the specification of myogenic satellite cells / P. Seale, L. A. Sabourin, A. Girgis-Gabardo [et al.] // Cell. — 2000. — Vol. 102 (6). — P. 777–786. — DOI: 10.1016/s0092-8674(00)00066-0.
5. Harri J. B. Myotoxic phospholipases A2 and the regeneration of skeletal muscles / J. B. Harris // Toxicon. — 2003. — Vol. 42. — P. 933–945. — DOI: 10.1016/j.toxicon.2003.11.011.
6. Autologous transplantation of CD34(+) bone marrow derived mononuclear cells in management of non-reconstructable critical lower limb ischemia / A. M. Ismail, S. M. Abdou, H. A. Aty [et al.] // Cytotechnology. — 2016. — Vol. 68 (4). — P. 771–781. — DOI: 10.1007/s10616-014-9828-7.
7. Hypoxia preconditioned mesenchymal stem cells improve vascular and skeletal muscle fiber regeneration after ischemia through a Wnt4-dependent pathway / L. Leroux, B. Descamps, N. F. Tojais [et al.] // Molecular Therapy. — 2010. — Vol. 18(8). — P. 1545–1552. — DOI: 10.1038/mt.2010.108.
8. Liew A. Therapeutic potential for mesenchymal stem cell transplantation in critical limb ischemia / A. Liew, T. O’Brien // Stem Cell Research & Therapy. — 2012. — Vol. 3 (4). — Article ID: 28. — DOI: 10.1186/scrt119.
9. Elshaer S. L. Cell Therapy and critical limb ischemia: evidence and window of opportunity in obesity / S. L. Elshaer, R. E. Lorys, A. B. El-Remessy // Obesity & Control Therapies. — 2016. — Vol. 3 (1). — Article ID: 121. — DOI: 10.15226/2374-8354/3/1/00121.
10. Treatment of muscle injuries with platelet-rich plasma: a review of the literature / K. Setayesh, A. Villarreal, A. Gottschalk [et al.] // Current Reviews in Musculoskeletal Medicine. — 2018. — Vol. 11 (4). — P. 635–642. — DOI: 10.1007/s12178-018-9526-8.
11. Peripheral nerve lesions after a mechanically induced limb ischemia / А. Pidlisetskyy, S. Savosko, О. Dolhopolov [et al.] // Georgian Medical News. — 2021. — Vol. 310. — P. 165–169.
12. Administration of platelet-rich plasma or concentrated bone marrow aspirate after mechanically induced ischemia improves biochemical parameters in skeletal muscle / А. Т. Pidlisetsky, G. V. Kosiakova, T. M. Goridko [et al.] // The Ukrainian Biochemical Journal. — 2021. — Vol. 93 (3). — P. 30–38. — DOI: 10.15407/ubj93.03.030.
13. Turner N. J. Regeneration of skeletal muscle / N. J. Turner, S. F. Badylak // Cell and Tissue Research. — 2012. — Vol. 347 (3). — P. 759–774. — DOI: 10.1007/s00441-011-1185-7.
14. Langridge B. Regenerative medicine for skeletal muscle loss: a review of current tissue engineering approaches / B. Langridge, M. Griffin, P. E. Butler // Journal of Materials Science. Materials in Medicine. — 2021. — Vol. 32 (1). — Article ID: 15. —DOI: 10.1007/s10856-020-06476-5.
15. Influence of platelet-rich and platelet-poor plasma on endogenous mechanisms of skeletal muscle repair/regeneration / F. Chellini, A. Tani, S. Zecchi-Orlandini [et al.] // International Journal of Molecular Sciences. — 2019. — Vol. 20 (3). — Article ID: 683. — DOI: 10.3390/ijms20030683.
16. Punduk Z. Single dose of intra-muscular platelet rich plasma reverses the increase in plasma iron levels in exercise-induced muscle damage: A pilot study / Z. Punduk, O. Oral, N. Ozkayin [et al.] // Journal of Sport and Health Science. — 2016. — Vol. 5 (1). — P. 109–114. — DOI: 10.1016/j.jshs.2014.11.005.
DOI: http://dx.doi.org/10.15674/0030-59872021463-69
The influence of regenerative technologies on recovery processes in leg after traumatic ischemia (experimental study)
A. T. Pidlisetsky 1, 2, O. V. Dolhopolov 1, S. I. Savosko 3, O. M. Makarenko 4
1 SI «Institute of Traumatology and Orthopedics NAMS of Ukraine», Kyiv
2 Communal non-profit enterprise ENT «Lviv Regional Hospital for War Veterans and Repressed named after Yu. Lypa». Ukraine
3 Bohomolets National Medical University, Department of Histology and Embryology, Kyiv. Ukraine
4 Interregional Academy of personnel Management, Kyiv. Ukraine
Post-traumatic muscle ischemia results from severe injury and can lead to muscle dysfunction. Therefore, patient management and treatment are very significant in all periods of injury. New methods are performed, especially using regenerative technologies to avoid complications and improve longterm outcomes.
Objective. To determine histological changes in the muscles of the injured limb after traumatic ischemia after injection of plateletrich plasma, Bone marrow stem cell concentrate (BMAC), and Stromal vascular fraction (SVF) prepared from adipose tissue on the 5, 15, and 30 days. Material and methods. Experiments were conducted on rabbits (Chinchilla breed). A tourniquet imposed on a lower limb, from the middle third of the thigh to the ankle joint. After 6 hours, the tourniquet was removed. The animals were divided into four groups: control, plateletrich plasma, bone marrow stem cell concentrate, and stromal vascular fraction prepared from adipose tissue—histological muscle changes provided by Tescan Mira 3 LMU (Czech Republic) in scanning transmission electron microscopy.
Results. On the 5th day after the experiment were no significant histological changes in muscles but in the contrary on the 15 days after experiment in BMAC and SVF groups detected new muscle fibers formation in necrotic areas and myonucleus organization. On the 30th day new angiogenesis was detected around muscle fibers. Plateletrich plasma group characterized by massive connective tissue formation in necrotic areas.
Conclusions. Necrosis and progressive muscle hypotrophy are unavoidably for this type of injury. It was shown that BMAC and SVF could stimulate regeneration and angiogenesis. Key words. Traumatic ischemia, necrosis, histological changes in muscles.