Ультрасонографічне дослідження скелетних м’язів в умовах травматичної ішемії (експериментальне дослідження)
1 1 ДУ “Інститут травматології та ортопедії НАМН України”
2 Комунальне некомерційне підприємство Львівської обласної ради «Львівський обласний госпіталь ветеранів війн та репресованих імені Юрія Липи»,
3 Національний медичний університет імені О. О. Богомольця
Посттравматична ішемія м’язів кінцівок є наслідком тяжкої травми і призводить до стійкого порушення їхньої функції. Тактика ведення і лікування пацієнтів є визначальною на всіх етапах, тому розробляються новітні методи лікування із застосуванням клітинних технологій для запобігання розвитку ускладнень і покращення віддалених результатів лікування.
Мета: визначити кореляцію між гістологічними і ультрасонографічними показниками (якісними та кількісними) у м’язах після травматичної ішемії та порівняти результати.
Матеріали та методи. Дослідження проводили на кролях породи Шиншилла. Тваринам накладали джгут на нижню кінцівку від середньої третини стегна до гомілковостопного суглоба, через 6 годин його знімали. Розроблене програмне забезпечення для визначення текстури сонографічного зображення (δ-ентропії) дозволило оцінити якісні та кількісні зміни в пошкоджених м’язах. Кореляційний аналіз проводили між сонографічними і гістологічними змінами у м’язах.
Результати. Морфометрично оцінено відносну кількість структурно зміненої тканини і зіставлено з ентропією. Виявлено високий кореляційний зв’язок пошкодження м’язів з вертикальною δ-ентропією і це вказує на те, що сонографія з високою вірогідністю на ранніх термінах дає можливість виявити ділянки некрозу і, меншою мірою, фіброзу при розвитку ішемічної контрактури кінцівки.
Висновки. Отриманий високий позитивний кореляційний зв’язок між гістологічним показником пошкодження м’язової тканини (передусім атрофія м’язових волокон і фіброз) та результатами сонографічної обробки даних, а саме вертикальної δ-ентропії, має саме клінічне значення з точки зору встановлення тяжкості некротичного ураження того чи іншого сегменту кінцівок і прогнозування фіброзних змін, формування контрактури кінцівки.
Ключові слова: травматична ішемія, некроз, гістологічні зміни в м’язах.
Вступ
Діагностика та лікування ішемічної контрактури Фолькмана (ІКФ) – одна з найбільш складних проблем травматології та ортопедії [1]. Одним із непростих завдань, що виникають при лікуванні пацієнтів з ішемічною контрактурою, є чітка діагностика та прогнозування перебігу в реактивно-відновному періоді (9–18 місяців від епізоду компартмент-синдрому) [2–4]. На прогноз впливають безпосередні наслідки пошкодження м’язової тканини наприкінці цього періоду, а саме: кількість м’язових волокон та динаміка некротичних змін. Тому питання методів чіткого, ґрунтовного визначення характеру патологічного процесу в уражених м’язах є надзвичайно важливим.
Аналіз літератури з цієї проблеми дозволив виявити лише поодинокі роботи [5], присвячені ультразвуковому дослідженню (УЗД) скелетних м’язів у випадку ішемічної контрактури, хоча, на нашу думку, саме ультрасонографічне дослідження із застосуванням сучасних методик цифрового опрацювання інформації може відкрити нові можливості у прогнозуванні перебігу реактивно-відновного періоду ішемічної контрактури [6–9], а за можливості проведення морфологічного дослідження – встановити особливості формування фіброзу на місці пошкоджених, некротизованих м’язів. Формування фіброзів є безпосередньою структурною основою контрактур, які негативно впливають на периферичні нерви пошкодженої кінцівки та її функцію [10]. У цій експериментальній роботі зроблено спробу оцінити ступінь пошкодження скелетних м’язів кінцівки та розвиток фіброзу після гострої ішемії кінцівки та за умов локального введення аутологічних клітинних регенеративних засобів.
Мета: визначити кореляцію між гістологічними і ультрасонографічними показниками (якісними та кількісними) у м’язах після травматичної ішемії та порівняти результати.
Матеріали та методи
Експерименти проведені на кролях (порода Шиншила) вагою 4,2–4,5 кг. Кролів утримували в умовах клініки для експериментальних тварин на стандартному харчовому раціоні з вільним доступом до їжі та води. Премедикацію та знеболення дослідних тварин здійснювали шляхом введення тіопенталу натрію (і. р., 60 мг/кг). Експериментальні маніпуляції проводили відповідно до правил «Regulations on the animal use of in research biomedical research», «European Convention for the protection of vertebrate animals used for experimental and other scientific purposes», «Guide for the Care and Use of Laboratory Animals» (Страсбург, 1986).
Модель експерименту полягала в моделюванні механічної ішемії кінцівки. Для цього на ліву задню кінцівку накладали медичний еластичний джгут (ширина джгута 5,5 см) тривалістю 6 годин. Вимірювання підфасціального тиску проводили у задньому глибокому футлярі гомілки за класичною інвазивною методикою Whitesides із застосуванням серійного приладу «Stryker Intra-Compartmental Pressure Monitor» (США) для одноразового визначення показників при кожному вимірюванні. При показниках підфасціального тиску (ПФТ) понад 10 мм рт. ст. (за рекомендаціями Харгеса (1964 р.)) на першому часі експерименту і понад 30 мм рт. ст. вважали, що компартментсиндром у кістково-фасціальних футлярах гомілки відбувся. Після зняття джгута та контролю ПФТ тваринам вводили аутологічні клітинні препарати у задній глибокий футляр гомілки. Тварини з ішемією кінцівки були розподілені на 4 дослідні групи:
1) основна група (n = 15) з ішемією;
2) група з ішемією та ін’єкцією концентрату плазми, збагаченої тромбоцитами (n = 15);
3) група з ішемією та ін’єкцією концентрованого аспірату кісткового мозку (n = 15);
4) група з ішемією та ін’єкцією стромально-васкулярної фракції жирової тканини (n = 15).
Тварин дослідних груп виводили з експерименту у три терміни – на 5, 15 і 30-ту добу. Контрольну групу склали інтактні тварини (n = 5).
Методики отримання клітинних препаратів, що вводились тваринам у експерименті
Методика одержання концентрату плазми, збагаченої тромбоцитами. Здійснювали забір крові з вушної вени кроля у кількості 5 мл, поміщали її у спеціальну пробірку фірми Artrex та проводили центрифугування зразка крові при 760 g протягом 8 хвилин для отримання концентрату плазми, збагаченої тромбоцитами (PRP). Отриманий концентрат евакуювали у 5 мл шприц і вводили його у задній глибокий футляр гомілки. Методика одержання суспензії клітин концентрованого аспірату кісткового мозку – Bone Marrow Aspirate
Concentrate (BMAC). Концентрований аспірат кісткового мозку отримували з проксимального відділу стегна кроликів. Кістковий троакар діаметром 10G вводили у проксимальний відділ стегна кролика, шприцом 5 мл виконували аспірацію кісткового мозку в об’ємі 5 мл. До аспірату додавали антикоагулянт цитрат декстрози АЦД-А (Baxter S.A., Belgium). Отриманий аспірат центрифугували при 760 g протягом 8 хвилин, після чого виконували аспірацію з пробірки 1 мл верхнього шару плазми та 1 мл середнього клітинного шару, що містив мононуклеарні лейкоцити, мезенхімальні та гепомоетичні клітини.
Методика одержання стромально-васкулярної фракції жирової тканини (СВФ). Через доступ до 2 см виконували забір 5 мг черевного сальника, який подрібнювали механічним способом до стану суспензії. Зазначену суспензію гомогенізували шляхом пропускання через систему двох з’єднаних шприців через 1 мм отвір, після чого її центрифугували при 760 g протягом 8 хвилин.
Ультразвукове дослідження проводили безпосередньо перед виведенням тварин з експерименту. Для подальшого аналізу сонографічних даних стосовно площини некрозу ішемізованих м’язів і визначення ентропії, як інтегрального показника текстури сонографічного зображення, нами спільно з Інститутом кібернетики імені В. М. Глушкова НАН України було розроблено комп’ютерне забезпечення (відділ інтелектуальних відеосистем реального часу, при сприянні члена-кореспондента НАН України, професора В. П. Боюна).
Теоретичним підґрунтям розроблення даної програми було визначення текстури сонографічного зображення.
В нашому дослідженні ми використали ознаки динамічності текстури, які, на наш погляд, більшою мірою відповідають поставленим задачам виявлення особливостей в ультразвукових зображеннях для порівняння здорових і некрозних ділянок ішемізованих м’язів.
Основи динамічної теорії інформації базуються на визначенні інформації як міри змін, якими супроводжуються всі процеси, що відбуваються у світі. Ця міра інформації виявилася надзвичайно плідною при вивченні інформаційних властивостей систем і процесів та дозволяє виділяти і використовувати корисну (динамічну) інформацію з випадкових стаціонарних і нестаціонарних сигналів, зображень, просторових полів, ітераційних процесів, рекурсивних процедур тощо, значно зменшуючи її надлишковість. Під δ-ентропією випадкового процесу Hδ розуміють величину, що визначається як середнє значення модуля похідної процесу та є мірою невизначеності змін випадкового процесу, тобто визначає динамічність процесу:
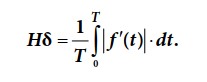
В дискретному вигляді Hδ може бути представлена як
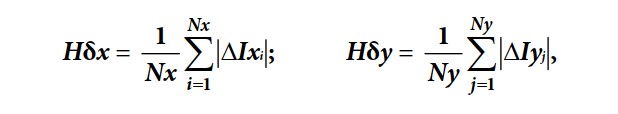
де Hδx, Hδу– δ-ентропія по рядках і колонках зображення; Nx, Ny – кількість пікселів в рядку, колонці; ΔIx, ΔIy– різниці (перепади) значень яскравості між сусідніми пікселами в рядку та колонці.
Розглядаючи зображення як реалізацію випадкового процесу по рядках або колонках, можна визначити кількість динамічної інформації в рядках і колонках, що характеризує динамічні властивості текстури тканини на ультразвуковому зображенні.
Першим етапом визначали площину некрозу. Датчик з частотою 7,5 МГц встановлювали вздовж і впоперек виявлених некротично змінених ділянок м’язів гомілки. За 100 % приймали фіксовану кількість пікселів, для апарату Philips HD-11 вона становила 248 на 587 пікселів. Самостійно вибирали ділянку сонографічної картинки, що підлягала дослідженню. Цю ділянку фіксували у вигляді прямокутника за допомогою спеціально розробленого графопобудовувача. У межах цієї визначеної площини програма вираховувала кількість нульових пікселів (тобто абсолютно чорних ділянок – ехонегативних) сонографічного зображення, які відображали некротичні зміни у м’язах (у цифровому та графічному зображеннях).
Другим етапом виконували визначення δ-ентропії у порівнянні однакових ділянок ішемізованих та контралатеральних здорових м’язів. Спочатку визначали площу некротизованої ділянки за принципами, описаними вище, ідентична площа автоматично відображалась на сонографічному зображенні здорового м’яза. Після фіксації однакових площин програма вираховувала δ-ентропію по горизонталі та по вертикалі. При цьому будувались відповідні графіки змін динаміки по рядках і колонках та обчислювались середні значення динаміки відповідно для рядів і колонок виділених ділянок зображення. Статистичними методами визначали середнє значення ентропії.
Для дослідження структурних змін м’язів гомілки на рівні ультразвукового дослідження тварин виводили з експериментів, а зразки м’язів гомілки виділяли і фіксували у 10 % нейтральному розчині формаліну. Після фіксації зразки заливали у парафін через ізопропанол-парафіновий метод і виготовляли 8 мкм мікрозрізи на мікротомі Thermo Microm HM 360 (Thermo Scientific, США).
Депарафіновані зрізи забарвлювали гематоксиліном та еозином для загальноморфологічного дослідження і червоним сіріусом для виявлення колагену (0,5 г Direct Red 80 (Magnacol Ltd, UK) в 500 мл насиченого розчину пікринової кислоти) [11]. Мікропрепарати заключали у бальзам (Merck, Німеччина) і досліджували на мікроскопі Olympus BX51. Мікропрепарати м’язів фотографували при збільшенні × 40 (кілька мікрофото об’єднували для одержання всього зразка м’яза). 5 мікропрепаратів було обрано з кожного зразка. За допомогою програмного забезпечення Carl Zeiss AxioVision SE64 Rel.4.9.1 ми вимірювали кількість пошкодженої (структурно зміненої) тканини у м’язі, тобто ділянки, що не містили м’язових волокон (ділянки некрозу, повної атрофії м’язових волокон, ділянки фіброзу, які були позитивно профарбовані червоним сіріусом). Ми представляли ступінь пошкодження як відсоток зміненої тканини до загальної площі мікроскопічно дослідженого зразка м’язу.
Статистичні дослідження. Статистичний аналіз даних проведено з використанням програмного забезпечення StatPlus ver. 7.3.0. (AnalystSoft Inc. USA). Нормальність розподілу вибірок даних проведено за критерієм Колмогорова–Смірнова. Міжгрупові різниці оцінювали за допомогою однопараметричного дисперсійного аналізу варіацій ANOVA з поправкою Bonferroni. Різницю між групами вважали достовірною при p ≤ 0,05. Кореляційний аналіз проведено за критерієм Спірмена. Дані представлено у вигляді середнього значення та похибки середніх (Mean ± SEM).
Результати та обговорення
Результати
В результаті обробки даних δ-ентропії були отримані узагальнені середні значення динаміки, що дозволило оцінити її зміну між двома зображеннями, а графіки змін динаміки по рядках і колонках дозволяли використати додаткові ознаки змін щільності тканини. Такими додатковими ознаками були: максимальні і мінімальні відхилення в графіках від узагальнених середніх значень; відстані між екстремумами на графіках, які характеризують товщини шарів тканини та їх зміни; низька динаміка ділянки була ознакою некрозу, яку можна було сегментувати та оцінити її площу і відсоток від досліджуваного зображення тощо.
Результати дослідження δ-ентропії в експериментальних групах надані в табл. 1. Статистичний аналіз показав достовірно меншу вертикальну δ-ентропію на 5-ту добу у групі з механічною ішемією і після введення BMAC. На 15-ту і 30-ту добу рівень ентропії відновився до контрольних значень.
Морфометрично оцінили відносне пошкодження м’язової тканини після механічної ішемії. У табл. 2 наведено відсоток структурно зміненої тканини (сумарно відображає некроз, атрофію і фіброзні зміни) у гістологічно досліджених зразках м’язів. Виявлено достовірне збільшення щільності ділянок пошкодження на 30-ту добу після ішемії і введення СВФ, а після введення PRP та BMAC показник був меншим. Уражені ділянки м’язів характеризувалися атрофією м’язових волокон і розвитком фіброзу (у мікропрепаратах гістохімічно підтверджено наявність колагену). На 5-ту добу реєстрували м’язові волокна з різко зменшеним діаметром, а на 30-ту добу вже встановлено ділянки колагеногенезу, тобто у незворотньо пошкоджених зонах м’язів (переважно зовнішніх міонах групи м’язів гомілки) відбувається заміщення некротизованої тканини фіброзною сполучною тканиною.
Кореляційний аналіз показав високий зв’язок між вертикальною δ-ентропією і ступенем пошкодження м’язів на тлі механічної ішемії кінцівки (табл. 3). Кореляцію з горизонтальною δ-ентропією виявлено тільки у групі з аспіратом клітин кісткового мозку, і ці результати мали протилежний напрямок між термінами. Ми дійшли висновку, що значущим показником у дослідженні пошкодження м’язів при сонографії є вертикальна δ-ентропія.
Таким чином, запропонована оцінка динаміки зображення була використана для проведення кореляційного зв’язку між рівнем пошкодження скелетних м’язів і параметрами сонографії ішемізованих м’язів. Зроблено висновок, що за рівнем вертикальної δ-ентропії можна оцінювати і прогнозувати тяжкість компартмент-синдрому і структурні зміни м’язів у реактивно-відновлювальному періоді.
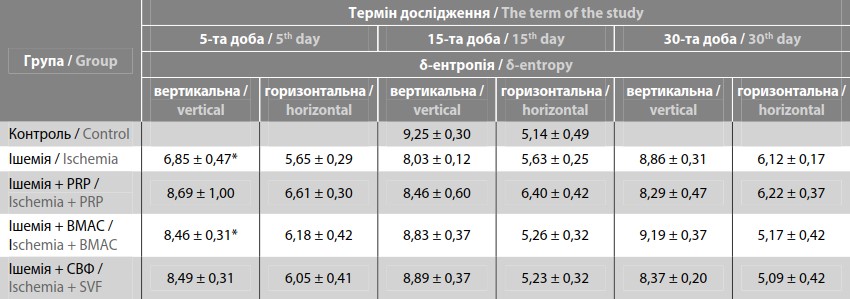
Примітка / Notes: * – вірогідні відмінності порівняно з показниками контрольної групи, p ≤ 0,05 / * – significant differences compared with control group p ≤ 0.05.
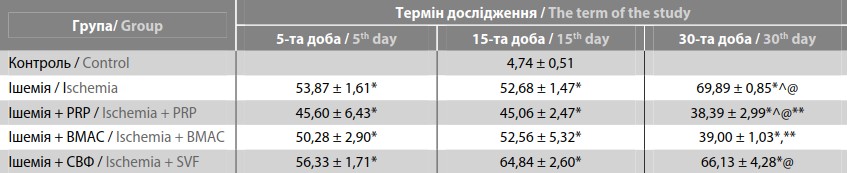
Примітки / Notes: * – вірогідність відмінностей зі статистичною значущістю p ≤ 0,05 порівняно з показниками контрольної групи; ** – p ≤ 0,05 – порівняно з показниками групи з ішемією; @ – p ≤ 0,05 – порівняно з показниками на 5-ту добу; ^ – p ≤ 0,05 порівняно з показниками на15-ту добу / * – the probability of differences with statistical significance p ≤ 0.05 compared with the control group; ** – p ≤ 0.05 – compared with the group with ischemia; @ – p ≤ 0.05 – compared with the indicators on the 5th day; ^ – p ≤ 0.05 compared with the indicators on the 15th day.
Таблиця 3 / Table 3 Ступінь кореляції між пошкодженням ішемізованих м’язів і Δ-ентропією / The degree of correlation between ischemic muscle injury and Δ-entropy

Обговорення
Контрактура кінцівки розвивається при стійкому ішемічному ураженні м’язів, що може бути спричинено дефіцитом перфузії кровоносних судин при артеріальній емболії або бути наслідком підвищеного тиску на тканини. Коли внутрішньотканинний тиск перевищує 30 мм рт. ст., тоді як у нормі він становить менше 10 мм рт. ст., виникає компартмент-синдром. Це призводить до розвитку некрозу у тканинах кінцівки, зокрема скелетних м’язах, а останнє провокує/стимулює проліферацію фібробластів, синтез колагену і формування фіброзних змін [1]. У цій роботі ми зробили спробу провести кореляцію між розвитком фіброзних змін у пошкоджених м’язах і результатами сонографії. Для цього дослідним тваринам моделювали механічну ішемію, яка тривала 6 годин, і це викликало такі порушення: механічне пошкодження м’яких тканин, підвищення внутрішньотканинного тиску понад 30 мм рт.ст., некроз скелетних м’язів і розвиток фіброзу. Ми вважаємо, що використана модель є вдалою для дослідження патофізіології ішемічної контрактури і може бути модельним об’єктом в оцінці динаміки атрофії м’язів, фіброзу, а також впливу різних способів лікування.
За результатами ультразвукових досліджень ішемічне ураження м’язів мало характерну сонографічну картину, яка полягала в неоднорідності (мозаїчності) структурних змін, наявності зон перебудови м’язової тканини (некроз та фіброз), залежала від давності травми, розповсюдженості патологічних змін м’язової тканини та мала характерні відмінності від інших патологічних процесів (денерваційного, травматичного тощо). Сонографія дала можливість неінвазивно та об’єктивно оцінити щільність м’язів у пошкодженій гомілці і стан кістково-фасціального футляру, зокрема. За змінами інтенсивності зображення можна судити про ступінь тяжкості та розповсюдженість патологічного процесу (появу чорних, ехонегативних ділянок). Особливістю наслідків ішемії м’язів у перші місяці реактивно-відновного періоду є деструктурованість, збільшення товщини за рахунок набряку, неоднорідність змін м’язової тканини з наявністю гіпоехогенних осередків некрозу та гіперехогенних зон різної величини і форми. Зі збільшенням давності патологічного процесу наростають атрофічні та фіброзні зміни, які також впливають на неоднорідне збільшення ехощільності і мозаїчність структури пошкоджених м’язів. Вважаємо за доцільне спиратися не тільки на якісні показники структури м’язів, але й на кількісні параметри – коефіцієнт ехощільності, а саме вертикальну δ-ентропію, які надають можливість чітко визначати ступінь незворотності ішемічних змін. Застосування комп’ютерного забезпечення дозволило оцінити відсоток некрозу, що має велике прогностичне значення.
Описані в нашій статті дані дали можливість сформулювати кілька важливих висновків. Компресійна ішемія викликала обширний некроз м’язів. Модель еластичної манжети тривалістю 6 годин виявилась досить вдалою і викликала поєднану дію двох патогенетичних чинників ішемічного ураження тканин кінцівки. Це, власне, механічне пошкодження, тому зовнішні (периферійні) міони м’язів були некротизовані, і механічне пошкодження судин м’язів спричиняло вже вторинне ішемічне пошкодження м’язової тканини. Враховуючи те, що диференціювати лімфоцити і клітини-попередники у мікропрепаратах, забарвлених гематоксиліном та еозином, неможливо, ми не можемо використовувати методики, які включають шкали оцінки пошкодженням м’язового волокна із запальною інфільтрацією [12]. Крім того, існують труднощі в достовірній диференціації різного ступеня пошкодження м’язових волокон: не складно відрізнити інтактне м’язове волокно від атрофованого, проте важко це зробити на ранніх етапах атрофії, коли цитологічні ознаки пошкодження слабко виражені [13]. Тому ми пішли іншим шляхом. Зразки м’язів були розділені вздовж своєї осі. Досліджували лише поздовжні зрізи, оскільки при тяжкому механічному пошкодженні м’язів кінцівки інтерес має бути зосереджений на безперервності м’язових волокон [14] і ультразвукове дослідження також показує картину м’яза у поздовжній проекції. У мікропрепаратах ми виявили неоднорідність (мозаїчність) пошкодження м’язу, тому як альтернативу оцінці великого числа полів ми вимірювали кількість пошкодженої і структурно зміненої тканини у м’язі, тобто ділянки, які не містили м’язових волокон – сумарно ділянки некрозу, повної атрофії м’язових волокон і фіброзу. Ми представляли ступінь пошкодження як відсоток зміненої тканини у загальному зразку м’яза, як альтернативу методу, де визначають відсоток пошкоджених м’язових волокон до загального числа волокон у зразку м’яза [15]. Подібну техніку використали інші автори [16] і додатково перевели відсоток пошкодженої тканини у м’язі у бали (від 0 до 5). Ми вирішили не робити додаткових перетворень і таке представлення даних у нашій роботі є зручним для порівняння з рівнем ентропії при ультразвуковому дослідженні.
Висновки
Отриманий високий позитивний кореляційний зв’язок між показником пошкодження м’язової тканини (першо чергово атрофія м’язових волокон і фіброз) та результатами сонографічної обробки даних, а саме вертикальної δ-ентропії має саме клінічне значення з точки зору встановлення тяжкості некротичного ураження того чи іншого сегменту кінцівок і прогнозувати фіброзні зміни, формування контрактури кінцівки. На 30-ту добу виявлено затримку структурних змін після введення концентратів тромбоцитарної плазми і клітин кісткового мозку, хоча сонографія не показала різниці між 15-ю і 30-ю добою. Це вказує на те, що сонографія з високою вірогідністю дозволяє виявити ділянки некрозу, а щодо фіброзу чутливість методу менша, хоча ми не виключаємо збільшення ехогенності при формуванні значних фіброзів. Одержані результати розширюють діагностичний діапазон вибору функціональних і лабораторних методів при лікуванні пацієнтів у реактивно-відновлювальному періоді ішемічної контрактури.
Ultrasonographic examination of skeletal muscles in traumatic ischemia (experimental study)
Serhii S. Strafun 1, Andriy T. Pidlisetsky 1, 2, Serhii I. Savosko 3, Igor V. Gaiovych 1, Oleksii V. Dolhopolov 1
1 SI “Institute of Traumatology and Orthopedics of NAMS of Ukraine”
2 Non-Profit Municipal Enterprise of Lviv Oblast Council » Yurii Lypa Lviv Regional Hospital for War Veterans and the Repressed
3 Bogomolets National Medical University
Post-traumatic muscles ischemia of the extremities is the result of severe trauma and leads to permanent dysfunction. The tactics of management and treatment of patients are decisive at all stages, so the latest methods of treatment using cellular technologies are being developed to prevent the development of complications and improve long-term results.
Aim: to determine the correlation between histological and ultrasonographic parameters (qualitative and quantitative) in the muscles after traumatic ischemia and to compare the results.
Material and methods. The study was performed on rabbits breed Chinchilla. The animals were placed on a tourniquet on the lower limb from the middle third of the thigh to the ankle joint, after 6 hours it was removed. Developed software to determine the texture of the sonographic image (δ-entropy) allowed to assess the qualitative and quantitative changes in the damaged muscles.
Correlation analysis was performed between sonographic and histological changes in the muscles.
Results. The relative amount of structurally altered tissue was morphometrically estimated and compared with entropy. A high correlation between muscle damage and vertical δ-entropy has been found, indicating that high-probability sonography can detect areas of necrosis and, to a lesser extent, fibrosis in the development of ischemic limb contracture.
Conclusions. The obtained high positive correlation between the histological index of muscle tissue damage (especially atrophy of muscle fibers and fibrosis) and the results of sonographic data processing, namely vertical δ-entropy, have clinical importance in terms of establishing the severity of necrotic lesions segments of the extremities and the prediction of fibrous changes, formation of limb contracture.
Key words: traumatic ischemia, necrosis, histological changes in the muscles.
Список використаних джерел / References
1. Mirza TM, Shrestha AB. Volkmann contracture. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021.
2. Balakrishnan G. Ischaemic contracture of the hand. Indian J Plast Surg. 2006; 39:94-102.
3. Horta R, Oliveira N, Ferreira MC, Nascimento R, Silva A. Reconstruction of a chronic volkmann contracture following forearm revascularization with burkhalter’s procedure and fractional flexor tendon lengthening after a failed stiles-bunnell transfer. J Hand Microsurg. 2019;11(Suppl 1):S36-S41. DOI: 10.1055/s-0039-1683457.
4. Kullmer K, Olivier L, Eysel P, Rompe JD, Schmit-Neuerburg KP. Traumatically-indused compartment syndrome of the tibia. Ultrasound diagnosis for qualitative assessment of late sequelae of musculature after dermatofasciotomy. Unfallchirurgie. 1997;23(3):87-91. DOI: 10.1007/BF02628912.
5. Fletcher MD, Spicer D, Warren PJ. Delayed presentation of compartment syndrome following gastrocnemius tear. Acta Orthop Belg. 2001;67(2):190-2.
6. Strafun SS, Brusko AT, Lyabakh AP, Leskov VG, Tymoshenko SV. [Prevention, diagnosis and treatment of ischemic contractures of the hand and foot]. Kyiv: Stylos; 2007. 264 p. Ukrainian.
7. Strafun SS, Hrytsai MP, Vovchenko AYA, Gaiko OG, Kurinny IM, Dolhopolov OV. [Ultrasound diagnosis of post-traumatic ischemic injuries of the tibia due to fracture of its bones]. Trauma. 2011;12(2):28-32. Ukrainian.
8. Gaiko OG. [Sonographic examination of muscle density in patients with sequelae of peripheral nerve injury of the upper extremity]. Bulletin of orthopedics, traumatology and prosthetics. 2010; 4:57-61. Ukrainian.
9. Lyabakh AP, Vovchenko GYa. [The use of ultrasound in assessing the structural and functional state of muscles in patients with ischemic foot contracture]. Clinical surgery. 2002; 3:45-47. Ukrainian
10. Meena DK, Thalanki S, Patni P, Meena RK, Bairawa D, Bhatia C. Results of neurolysis in established upper limb Volkmann’s ischemic contracture. Indian J Orthop. 2016;50(6):602-9. DOI: 10.4103/0019-5413.193483
11. Wegner KA, Keikhosravi A, Eliceiri KW, Vezina CM. Fluorescence of picrosirius red multiplexed with immunohistochemistry for the quantitative assessment of collagen in tissue sections. J Histochem Cytochem. 2017;65(8):479-90. DOI: 10.1369/0022155417718541.
12. Hori K, Tsujii M, Iino T, Satonaka H, Uemura T, Akeda K et al. Protective effect of edaravone for tourniquet-induced ischemia-reperfusion injury on skeletal muscle in murine hindlimb. BMC Musculoskelet Disord. 2013; 14:113. DOI: 10.1186/1471-2474-14-113.
13. McCormack MC, Kwon E, Eberlin KR, Randolph M, Friend DS, Thomas AC et al. Development of reproducible histologic injury severity scores: skeletal muscle reperfusion injury. Surgery. 2008;143(1):126-33. DOI: 10.1016/j.surg.2007.06.005.
14. Stacy BA, Costidis AM, Keene JL. Histologic changes in traumatized skeletal muscle exposed to seawater: a canine cadaver study. Vet Pathol. 2015;52(1):170-5. DOI: 10.1177/0300985814522820.
15. Kuroda Y, Togashi H, Uchida T, Haga K, Yamashita A, Mitsuaki Sadahiro M. Oxidative stress evaluation of skeletal muscle in ischemia-reperfusion injury using enhanced magnetic resonance imaging. Sci Rep. 2020;10: 10863. DOI: 10.1038/s41598-020-67336-4.
16. Takhtfooladi HA, Takhtfooladi MA, Karimi P, Asl HA, Mobarakeh SZ. Influence of tramadol on ischemia-reperfusion injury of rats’ skeletal muscle. Int J Surg. 2014; 12(9):963-8. DOI: 10.1016/j.ijsu.2014.07.015.